Повреждение нейронов зачастую приводит к необратимым последствиям, поскольку тончайшие механизмы транспортировки РНК внутри клетки могут нарушаться при заболеваниях или травмах. Такие нарушения наблюдаются при состояниях вроде бокового амиотрофического склероза или спинальной мышечной атрофии, а также после повреждений спинного мозга. Когда жизненно необходимые молекулы РНК не способны достичь нужных участков клетки, процессы восстановления постепенно останавливаются, ухудшая прогноз.
Прорыв Стэнфордских ученых: адресная доставка РНК
Сегодняшние научные достижения из Стэнфордского университета дают новую надежду. Группа исследователей, включая Стэнли Ци и Менгтинг Хань, совершили революционный шаг, разработав уникальную технологию, позволяющую транспортировать РНК прямо к нужным местам внутри нейронов. Новый подход получил название «пространственная РНК-медицина» и закладывает прочную основу для создания инновационных лекарств. Ученые уверены, что их работа обеспечит эффективное восстановление нервных тканей как при хронических заболеваниях, так и при последствиях травм.
Стэнли Ци, ведущий исследователь проекта, объясняет: «В нашей технологии мы используем потенциал CRISPR для создания "пространственного почтового индекса", который направляет молекулы РНК точно к тем участкам, где их действие наиболее важно». Благодаря этому сравнительно новому методу появляется возможность восстанавливать повреждённые сегменты нейрона и даже стимулировать их повторный рост, что раньше казалось невозможным.
Почему локализация РНК важнее всего
Внутри организма отдельный нейрон может достигать в длину одного метра — этот факт сам по себе подчеркивает важность доставки молекул на огромные по меркам клетки расстояния. Старение, генетические мутации или физические повреждения зачастую вмешиваются в транспортные процессы, и жизненно необходимая РНК "застревает", не успевая к зоне повреждения вовремя. Как результат — терапевтический эффект теряется.
«Даже самая многообещающая РНК будет бесполезна, если ее миссия ограничится другим участком клетки», — отмечает Стэнли Ци. Перед исследователями стояла непростая задача: создать надёжный инструмент доставки, способный доводить нужные молекулы до места выполнения функции. CRISPR-TO стал первым шагом в реализации этой идеи.
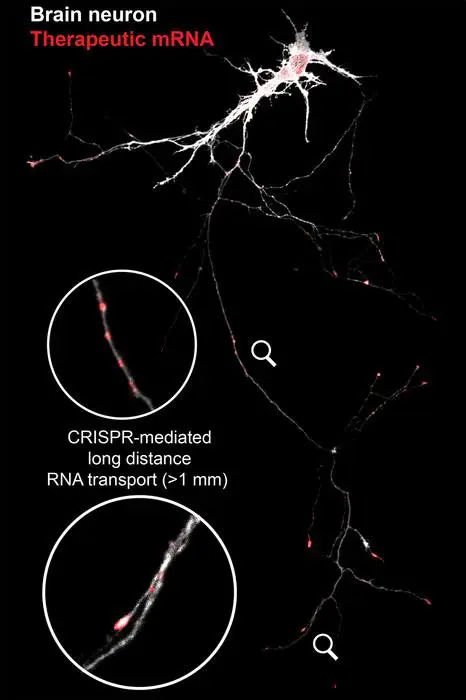
CRISPR-TO — программируемая доставка РНК
Ключевой инструмент, применённый командой Стэнфордского университета — это модифицированная версия технологии CRISPR под названием CRISPR-Cas13. Если классический CRISPR обычно ассоциируется с редактированием генетического кода, здесь Cas13 был переосмыслен: теперь он не «разрезает» РНК, а аккуратно доставляет её в указанный адрес.
CRISPR-TO способен распознавать определённые адресные маркеры внутри клетки, словно почтовый индекс, и перемещать молекулы РНК туда, где они нужнее всего. Такой подход делает возможным совершенно уникальный контроль за биологическими процессами, позволяя учёным создавать собственные адресные метки и направлять молекулы РНК в разнообразные клеточные компартменты — от ядра до кончиков нейритов.
Повышение регенерации нейронов и перспективы терапии
Используя CRISPR-TO, команда провела масштабные эксперименты на нейронах мозга мыши и обнаружила сразу несколько РНК-фрагментов, существенно увеличивающих скорость роста нейритов. Особенно впечатляющим результатом стало увеличение длины нейритов на 50% всего за одни сутки после адресной доставки определённой молекулы.
Менгтинг Хань с радостью делится результатами: «Каждый новый фрагмент РНК, обнаруженный нами, расширяет спектр возможностей. Это первое в истории средство, позволяющее управлять пространственным распределением РНК внутри нейрона, а значит, открывает новые терапевтические стратегии для лечения болезней, ранее считавшихся неизлечимыми».
CRISPR-TO используется и для дальнейшего поиска молекул с максимальным восстановительным потенциалом, как для моделирования нейродегенеративных состояний на мышах, так и для работы с человеческими клетками. Такой фундаментальный подход к отбору лучших вариантов РНК увеличивает шансы практически для всех групп пациентов.
Будущее пространственной РНК-медицины
Совершенно очевидно, что наука стоит на пороге мощных открытий. По мнению Стэнли Ци, исследование только начинается: «Сегодня мы выявили необыкновенные возможности пространственной организации молекул РНК для активации процессов восстановления в мозге. Речь идет не только о лечении симптомов, а о реальной регенерации нейрональных структур».
Благодаря CRISPR-TO появилась возможность не только работать с собственными молекулами клетки, но и перестраивать доставку медикаментозных средств на основе РНК. Таким образом, перспективы для пациентов становятся заметно шире: теперь доставка терапевтических агентов будет не только точной, но и максимально безопасной, ведь они поступают непосредственно в очаг болезни.
Программируемая адресная доставка — технология завтрашнего дня
Новый этап в развитии медицины уже начался. Возможности CRISPR-TO для адресной доставки РНК позволяют настраивать транспортировку под потребности конкретной клетки и ткани. Это полностью меняет взгляд на выздоровление после травм, возрастных изменений или тяжелых неврологических болезней.
Стэнли Ци с энтузиазмом отмечает: «Теперь мы можем запланировать доставку любой РНК к любым клеткам — независимо от их типа или местоположения. Главное — обеспечить присутствие нужной молекулы в нужной точке и в нужное время. Мы полны оптимизма по поводу будущих открытий и терапевтических инструментов, которые обязательно появятся вслед за этим исследованием».
На фотографии: Менгтинг Хань из команды Стэнфордского университета
Источник: scientificrussia.ru



